Silicio charakteristika periodiškai sistemai
PSHE charakteristikos 1. Pozicija PSE. 1. Pozicija PSE. 4 grupė, namų pogrupis, 4 grupė, namų pogrupis, 3 laikotarpis 3 eilutė 3 eilutė 3 eilutė Ar \u003d 28 AR \u003d 28 oksidacijos laipsnis: -4, oksidai: oksidai: SIO (abejingumas) SIO 2 (rūgštus) SiO2 (rūgštus) rūgšties-flown flown h 2 sio 3 h 2 sio 3
Z \u003d + 14 z \u003d p \u003d 14 +1 p \u003d 14 0 n \u003d 28-14 \u003d 14 0 n \u003d 28-14 \u003d 14 E \u003d 14 E \u003d 14 +14) 2) 8) 4 +14) 2) 8 ) S 2s 2p 3s 3p

Silicis yra trečias (po deguonies ir vandenilio) silicis yra trečias (po deguonies ir vandenilio) elemento paplitimas: jos dalis turi būti paplitusi su elementu: jis yra 16,7% visų sausumos žievės atomų skaičiaus. 16,7% visų sausumos žievės atomų skaičiaus. Gamtoje silicis yra tik silicio rūgšties dioksidų ir druskų (silikatų) pavidalu. Aliuminiolicates yra labiausiai paplitusi. Gamtoje silicis yra tik silicio rūgšties dioksidų ir druskų (silikatų) pavidalu. Aliuminiolicates yra labiausiai paplitusi.

Pagrindiniai mineralai Silicis Pagrindiniai silicio mineralai AL 2 O 3 * 2SIO 2 * 2H 2 O - Baltas molis AL 2 o 3 * 2SIO 2 * 2H 2 O - baltas molio k 2 O * AL 2 O 3 * SIO 2 - lauko slyvų k 2 o * AL 2 O 3 * SIO 2 - lauko slyva k 2 o * al 2 o 3 * 6SIO 2 * H 2 O - MICA K 2 O * AL 2 O 3 * 6SIO 2 * H 2 O - SIO 2 SYDA 2-SYDA 2 SIO 2 Smėlio arba upės smėlis

Silicis yra pagrindinis mineralų ir uolų karalystės elementas. Dažniausiai jis randamas kvarco mineralų pavidalu (kurio veislės - Flint, silicio dioksidas (smėlis), agatas, Jasper) ir kalnų kristalas (kurio veislės yra: ametistas, dūminis topazas). Silicis yra pagrindinis mineralų ir uolų karalystės elementas. Dažniausiai jis randamas kvarco mineralų pavidalu (kurio veislės - Flint, silicio dioksidas (smėlis), agatas, Jasper) ir kalnų kristalas (kurio veislės yra: ametistas, dūminis topazas). Dažnai silicis beveik niekada nerastas. Dažnai silicis beveik niekada nerastas.

Kai kurie jūrų organizmai kaupia silicio dideliais kiekiais. Kai kurie jūrų organizmai kaupia silicio dideliais kiekiais. Savo turtingiems jūrų augalams yra dumblių dumblių, iš gyvūnų, daug silicio yra radiolių, silicio kempinės. Savo turtingiems jūrų augalams yra dumblių dumblių, iš gyvūnų, daug silicio yra radiolių, silicio kempinės.

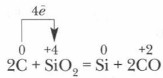
A. Pramonėje - anglies restauravimas elektros krosnyse a. Pramonėje - anglies mažinimas elektros krosnyse SIO 2 + 2C \u003d SI + 2CO SIO 2 + 2C \u003d SI + 2CO b. Laboratorijoje - silicio metalų b. Laboratorijoje - metalų restauravimas silicio 3sio 2 + 4al \u003d 3Si + 2al 2 o 3 3SIO 2 + 4AL \u003d 3SI + 2AL 2 O 3

1) Amorfinis silicio - rudos spalvos milteliai 1) Amorfinis silicio - rudos spalvos milteliai t lydymas 1420 C. t lydymas 1420 p. 2) kristalinis silicis - kietas, tamsiai pilkos spalvos su silpnu metaliniu blizgučiu, turi šilumos ir elektros laidumą 2) kristalinio silicio - kietas, tamsiai pilkas su silpnu metaliniu blizgučiu, turi šilumos ir elektros laidumą

A) sąveika su įprastinėmis medžiagomis. a) sąveika su įprastinėmis medžiagomis. SI-redukuojantis agentas SI-redukuojantis agentas 1) su halogenais 1) su SI + 2F 2F 2 \u003d SF 4 - silicio fluoridas SI + 2F 2 \u003d SF 4 - silicio fluoridas 2) su deguonimi 2) su deguonimi si + o 2 SIO 2 -OXYDE silicio (LV) SI + O 2 SIO 2-oksido silicio (LV) 3) su azotu 3) su azotu 3SI + 2N 2 \u003d si 3 n 4 silicio nitrido 3Si + 2n 2 \u003d si 3 n 4 nitrido silicio 4 ) Su anglies 4) su anglies SI + C \u003d SIC-anglies silicio arba SI + C \u003d SIC-Karbide Silicio arba Carborund Carborund

SI-OXIDIZER SI-oksiduojantis agentas 5) su metalais 5) su metalais SI + 2 mg \u003d t mg 2 si-ticide magnio si + 2 mg \u003d t mg 2 si-ticide magnio tiesiogiai su silicio vandeniliu neatsako. Tiesiogiai su silicio vandeniliu nereaguoja. SIH 4 yra gaunamas netiesiogiai. SIH 4 yra gaunamas netiesiogiai. Mg 2 si + 4hcl \u003d 2mgcl 2 + sih 4 mg 2 si + 4hcl \u003d 2mgcl 2 + SIH 4 (silawn, nuodingos dujos) (silawn, nuodų dujos)

B) sąveika su sudėtingomis medžiagomis 1) nuo halogenų vandenilio reakcijų tik su HF 1) iš halogenų augintojų reakcija yra tik su HF SI + 4HF \u003d SIF 4 + 2H 2 SI + 4HF \u003d SIF 4 + 2H 2 2) nuo rūgščių mišinio azoto ir skysčio 2) iš rūgščių. Reakcija yra tik su azoto ir skysčio 3SI + 12HF + 4HNO 3 \u003d 3SIF 4 + 4NO + 8H 2 O 3SI + 12HF + 4HNO 3 \u003d 3SIF 4 + 4NO + 8H2 + 8H 2 Pagal kitų rūgščių veiksmą tankus oksido plėvelė SIO 2 yra suformuotas ant silicio paviršiaus pagal kitų rūgščių ant silicio paviršiaus, yra suformuota tanki oksido plėvelė SiO 2 3 yra suformuota) šarmų sąveika 3) sąveika su šarmais SI + 2NAOH + H 2 O \u003d NA 2 SIO 3 + 2H 2 SI + 2NAOH + H 2 O \u003d NA 2 SIO 3 + 2H 2

Atidarymas. 1834 m. Rusų chemikas davė šį elementą į rusų vardą. 1834 m. Rusų chemikas davė šį elementą į rusų vardą. Silicio buvo atidarytas 1825 m., 1825 m. Atidarytas Švedijos chemikas Švedijos chemikas Berzelius. Berzelius.

Paraiška naudojama technikoje, kad gautų puslaidininkių medžiagą ir lydinius. Taip pat gauti stiklo ir cemento, pjovimo metalo - pjovimo mašinos. Jis naudojamas technikoje, kad gautų puslaidininkių medžiagas ir lydinius. Taip pat gauti stiklo ir cemento, pjovimo metalo - pjovimo mašinos.

Silicio oksidas (IV) arba silicio silicio dioksidas (IV) arba silicio dioksidas 1. pastatas: silicio oksidas (IV) neturi molekulinės (pvz., Anglies dioksido) ir branduolinio kristalų grotelės 1. Statyti: silicio oksido (IV) neturi molekulinės (pvz., Anglies dioksidas) ir atominės kristalinės grotelės, todėl SIO 2 kieta ir ugniai medžiaga, todėl SIO 2 kieta ir ugniai medžiaga, kuri nėra ištirpinta vandenyje ir rūgštys, išskyrus skystį (prisiminti halogenines druskos rūgštis). Kuris nėra ištirpintas vandenyje ir rūgštims, išskyrus pakuotę (prisiminkite halogeninės veisimo rūgštys).




Chemijos mokytojas: Malinovskaja Julia Vladislavovna
Abstrakta pamoka šia tema: "Anglies ir silicio padėtis periodinėje cheminių elementų sistemoje, šių elementų lyginamosios charakteristikos. Anglies alotropija. "
Klasė: 9 klasė.
Tikslas: Sukurti sąlygas sisteminti ir gilinti mokinių apie atomų struktūrą, kompozicijos santykiai - struktūra - medžiagų savybės
Užduotys:
Švietimo:
Apibendrinimas ir gilinimas žinių apie atomų struktūrą, priklausomai nuo periodinės sistemos padėties; Iš kompozicijos santykiai yra struktūra - savybės medžiagų ant altropinės anglies modifikacijų pavyzdį
Studentų bendrosios struktūros plėtra
Įgūdžių ugdymas analizuoti, palyginti, daryti išvadas, užmegzti santykius
Atskleisti ideologinę idėją apie kompozicijos, struktūros, savybių medžiagų santykį; Intelektualiai sukurtos asmenybės ugdymas; Komunikacijos kultūros švietimas
^ Pamokos tipas: Pagal didaktinį tikslą - žinių gerinimas ir taikymas; Pagal organizacijos metodą - žinių naudojimas ir susipažinimas su nauja medžiaga
Naudojamos švietimo technologijos:
Informacija
Asmeninės patirties technologija
Orientacijos technologija pažinimo tapatybės plėtrai
Forma: Pokalbio, nepriklausomos veiklos derinys
Įranga: Kompiuteris, projektorius, kompiuterių pristatymas, kolekcija: "Akmens anglių tipai", deimantų ir grafito kristalų grotelės mėginiai.
^ 1 etapo pamoka
Organizacinė. Pamokos temų paskelbimas.
Sveiki! Šiandien pamokoje kalbėsime apie du cheminius elementus.
Šių elementų pavadinimai kilę iš lotyniškų žodžių "Carbo" ir "Lyapis Sremyns". (Studentai iš karto supranta, kad tai bus apie anglies ir silicis.).
"Carbo" - "Carbonum" - tai "anglis" - anglis ir "Lyapis Sremyns" yra akmuo, kuris suteikia ugnies - silicio.
Šiandien pamokoje reikės pateikti lyginamąją šių elementų charakteristiką naudojant anksčiau gautus žinias.
Nešiojamuose kompiuteriuose studentai rašo pamokos temą: " Lyginamosios charakteristikos. \\ T Anglies ir silicio elementai. "
Palyginkite, tai reiškia pasirinkti pirmiausia, kriterijų palyginimas. Pasakykite man, prašome, kokie kriterijai mes, jūsų nuomone, turėtume palyginti. Studentai atsako: pozicija PS, atomų struktūra, valencija, oksidacija ir pan.
^ 2 etapo pamoka
Naudojant žinias apie atomų struktūrą, elementų charakteristikos PS, patys studentai užpildo save lyginamoji lentelė № 1.
# 1. Lyginamosios charakteristikos anglies ir silicio elementų
| ^ Kriterijų palyginimas | Nuo. anglies. \\ T | Si silicis |
| PS PS. | 2 laikotarpis, IV grupė, pagrindinis pogrupis (A) | 3 laikotarpis, IV grupė, pagrindinis pogrupis (A) |
| Statybos atomai | Z i \u003d + 6, p \u003d 6, e \u003d 6, n \u003d 12-6 \u003d 6, išoriniai e \u003d 4 | Z i \u003d + 14, p \u003d 14, e \u003d 14, n \u003d 28-14 \u003d 14, išorinis e \u003d 4 |
| Elektroninė atomų konfigūracija | 1s 2 2s 2 2P 2 | 1s 2 22 22 22 3S 2 3P 2 |
| Valenijos galimybės | II stacionarioje būsenoje IV sužadintoje būsenoje |
|
| Galimi oksidacijos laipsniai | nuo -4 iki +4 CH4, C 2 H 6, C24, CAC 2, C, C2 F 2, CO, C2 F 6, CO 2 | -4, 0, +2, +4 Mg 2 si, si, siino, SiO 2 |
| Radius Atom | dideja |
|
| Elektra (tikros skalės) | 2,5 | 1,9 |
| Aukštojo oksido formulė, jo charakteris, vardas | CO 2 rūgštis, anglies monoksidas (IV), anglies dioksidas, anglies dioksidas | SIO 2 - rūgštis, silicio oksidas (IV) |
| Aukštojo hidroksido formulė, jo charakteris, pavadinimas | H 2 CO 3 - silpna nestabili rūgštis (CO 2 + H 2 O), druskos - karbonatai | H 2 Sio 3 yra silpna rūgštis, turi polimero konstrukciją (SIO 2 NH 2 O), druskos - silikatai |
| Vandenilio ryšys | CH 4 - metanas | Sin 4 - Silan (nestabili) |
| Gamtoje | Reikalingas organinių medžiagų elementas | Dažniausiai (po deguonies) žemės plutos elemento |
Nepriklausomo darbo pabaigoje užpildant stalą, visi su mokytoju užpildykite iš anksto parašytą ant lentos stalo. Sąnarių užpildymo procese, studentai kartu su mokytoju švenčia, jie ištarti kai kurių elementų, kuriems reikia atkreipti dėmesį į:
Beveik visuose jo junginiuose, anglies ir silicis yra tetravalent, t.y. Duomenų atomai elementų yra susijaudintoje būsenoje. Mokytojas (studentas) parodo jį lentoje:
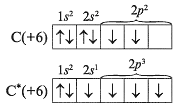
Dėl egzistavimo įvairios oksidacijos laipsniai anglies atomų organiniai junginiai, neorganinėmis medžiagomis, kurios yra būdingiausios oksidacijos laipsniai: -4, 0, +2, +4
Būdingas anglies ir silicio skirtumas yra anglies dioksido gebėjimas grandinės formavimui. Anglies atomai, jungiantis tarpusavyje, sudaro stabilius junginius, panašūs silicio junginiai yra nestabilūs.
^ 3 etapo pamoka
Nuo cheminių elementų charakteristikų - į paprastas medžiagas.
Darbas su kompiuterio pristatymu.
Anglies atomai yra apibūdinama alotropija. Studentai prisimena sąvokos apibrėžimą - "Allhotopy". Mokytojas klausia: "Ką anksčiau padengtų cheminiais elementais turi alotropinius pakeitimus?".
Studentai vadovauja pavyzdžiai: deguonies elementas (O) - O 2 - deguonis, o 3 - ozonas; SERA elementas (-ai) - krištolo ir plastiko sieros.
Be to, mokytojas klausia studentų, už juos gali būti žinomi alto anglies modifikacijos.
Anglis egzistuoja tokių paprastų medžiagų forma: deimantas, grafitas, karabinai, pilnas. Akmens anglis, suodžiai gali būti laikomi grafito veislėmis.
Interesų yra anglis.
Su juo, kitas primityvus žmogus buvo pažįstamas: jis rado jį ugnies viduryje ir po laužo veislės. Anglis turi didelį poringumą ir nesineša. 1785 m. Mokslininkas - "Teviy LoviTz" chemikas netyčia nutraukia vyno rūgštį (rudos spalvos dėl priemaišų) ant smėlio su anglies mišiniu. Lovitz surenkamas purškiamam tirpalui, filtruojama nuo smėlio su anglimi. Bespalvis medžiaga lieka filtre. Paaiškėjo, kad anglies absorbuojamos priemaišos, esančios wiccye. Taigi buvo atviras fenomenas, vadinamas adsorbcija.
Adsorbcija - Anglių ir kitų savybės kietųjų medžiagų Laikykite gazę ant jo paviršiaus ir tirpių. Medžiagos, kurių paviršiuje įvyksta adsorbcija, vadinama adsorbentais.
Anglies adsorbciją sukelia jo poringumas. Kuo daugiau porų, tuo geresnis anglies sorbcijos pajėgumas. Tačiau, paprastai, anglies poros yra užpildytos įvairiomis medžiagomis. Norėdami juos išvalyti, anglis yra šildomas vandens garų srove. Tokia anglis, su nuluptomis poromis, vadinamas aktyvuota.
Pirmas pasaulinis karasAdsorbcijos reiškinys buvo taikomas kovojant su apsinuodijimo cheminėmis medžiagomis. 1915 m. Buvo taikoma chloro (uždegimo dujos) vakarų priekyje Netoli IPRA miesto prieš anglų-prancūzų karius. Ataka Chloro atimta kovos su galimybe visam padalijimui (15 tūkst. Žmonių buvo neįgalūs, 5 tūkst. Mirę).
Rusų profesorius Nikolay Zelinsky (vėliau akademikas) išrado ir atliko bandymą 1915 m. Liepos mėn. Gase, veikdamas remiantis adsorbcijos reiškiniu.
Silicis sudaro paprastą medžiagą - kristalinį silicis. Taip pat yra amorfinis silicio milteliai balta spalva.
Be to, mokytojas sustoja ir reiškia kiekvienos fizinės savybės paprasta medžiagasuformuota anglies atomų (skaidres).
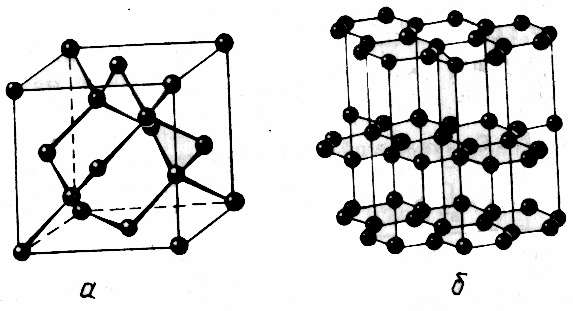
Mokytojas atkreipia studentų dėmesį į tai, kad deimantas ir grafitas, sudarytas iš anglies atomų turi tokias skirtingas fizines savybes. Kodėl? (Studentai ne visada gali atsakyti į šį klausimą). Mokytojas atkreipia dėmesį į įvairią deimantų ir grafito kristalų groteles struktūrą.
Deimantų kristale kiekvienas anglies atomas sudaro keturias stiprias kovalentines obligacijas, jie nukreipiami į Tetraedro viršūnes, visi atstumai tarp atomų yra vienodi. Grafitas, atstumas tarp atomų sluoksnyje yra daug mažesnis už atstumą tarp sluoksnių (kristalinių grotelių pavyzdžiai).
^ 4 etapo pamoka
Jo tikslas: bendrosios studentų struktūros išplėtimas, chemijos interpreacijos nustatymas su istorija.
Ankstesnėje pamokoje, kaip namų darbai, mokytojas pasiūlė studentams rasti Įdomūs faktai Apie deimantų istoriją ir paruošti našumą su kompiuterio pristatymu.
Jei yra studentų, kurie baigė užduotį, mokytojas suteikia jiems žodį, jei ne, tada jis sako ir rodo jo pristatymą.
^ 5 etapo pamoka
Apibendrinant. Atspindys.
Studentai atsako į klausimus:
Kokios naujos koncepcijos buvo tiriamos pamokoje?
Kokie klausimai sukėlė sunkumų? Ir tt
Mokytojas vertina tuos studentus, kurie parodė geras ir puikias žinias pamokos metu buvo aktyvi.
Bibliografija:
Levkin A.N. Bendra ir neorganinė chemija: egzaminų medžiagos. - SPB.: "Paritūra", 2003 - 240 s.
Malinovskaya yu.v. Chemija. 6-oji klasė / propaedeutic kursas. - SPB.: ICARO, 2002, - 76 p.
Taube P. R., Rudenko E. I. Nuo vandenilio iki Nobelia? - m.: Gosdo. Leidyba vidurinė mokykla", 1961 - 330 p.
Chemija: 9 ląstelių vadovė. uch. / Rudzitas g.e., Feldman F.G. - 11-asis ED. Pere. - m.: Apšvietimas, 2010 m
Sekos numeris yra 14, Core +14 mokestis Core - 14, elektronai - 14. III - 14 elektronų laikotarpis juda išilgai trijų energijos lygių. IV grupės numeris - prie išorinio energijos lygio yra 4 elektronai. Atom spindulys yra daugiau nei anglies - gebėjimas grįžti elektronų didėja. Metalo ir reabilitacijos savybės padidėja (palyginti su anglies). SI GE SN PB. Bendrosios charakteristikos. \\ T Silicis į poziciją periodinėje sistemoje. C.
2 pav. Nuo pristatymo "Silicon" Chemijos pamokoms temoje "Silicis"Matmenys: 960 x 720 pikselių, formatas: jpg. Norėdami atsisiųsti nuotrauką chemijos pamokai, spustelėkite dešiniojo pelės mygtuką paveikslėlį ir spustelėkite "Išsaugoti vaizdą kaip ...". Norėdami rodyti nuotraukas klasėje, taip pat galite atsisiųsti "silicio .ppt" pristatymą visiškai su visomis nuotraukomis Zip archyve. Archyvo dydis yra 562 kb.
Atsisiųsti pristatymąSilicis
"Silicio pamoka" - anglies dioksidas apie save ir žmoniją. Darbas poromis, abipusiu testu - jokios klaidos (5), dvi klaidos- (4) ir kt. 3% oro svaigimas, triukšmas ausyse, mieguistumas. 20% - viskas asmeniui. Dėl nemetalinių ir metalinių savybių pasireiškimo. Komandų sąmata. Ką galima pasakyti apie radii atomų dydį nuo anglies į priekį?
"Silicis ir jo junginiai" - apsvarstyti natūralius silicio junginius. Pateikite bendrą silicio elementą. Silicio gavimas. Silicis pirmą kartą buvo aptikta 1811 m. Gėjų Lyssak ir Terra. Atomų struktūra ir savybės. Silicio oksidas, priešingai nei anglies oksido (IV), nėra sąveikauja su vandeniu. Puslaidininkis. Tplant (SI) \u003d 1415? C, Taplav (Diamond) \u003d 3730? C.
"Silicio izotopai" - polikristalinio silicio gavimas. Didžiausios derinimo sklaidos grupės priklausomybė nuo atominės masės. Degiklis. Padaryti vieną kristalų sėklą. Zono išgrynintas silicis. Apsauginė danga. Izotopų praturtinto silicio-28 šiluminis laidumas. Auga vieninteliai kristalai. Izotopų koncentracijos pasiskirstymas pagal sėklų ilgį.
"Silicio junginiai" - įvairios kvarco. Jasper. Gauti silikatų. Natūralūs silikatai. Silicio oksidas. Mineralai, pagrįsti Sio2. Cheminės savybės SIO2. Silicio atidarymas. Silicis ir jo jungtys. Silicio. Agatas. Oksidacijos laipsnis. Elektroninė konfigūracija. Silikatai ir vandenilis. Kalnų krištolas. Rasti gamtoje. Sylan.
"Anglies ir silicis" - cheminės savybės. Viena iš lengviausių kietųjų medžiagų. Silikato plytos. Šis mišinys vadinamas generatoriaus dujomis. Deimantų grotelės modelis. Gautos dujos susideda iš laisvo azoto ir anglies oksido (ii). Daugiau nei 99% anglies atmosferoje yra anglies dioksido pavidalu. Pozicija PSHE.
"Silicis" - iki silicio atsiradimo pabaigos nėra pakankamai 4 elektronų. Silicio oksidas (IV). Bendras silicio charakteristikas periodinėje sistemoje. Silicio laboratorijose, atkuriant SiO2 silicio oksidą. Fizinės savybės. Silikatai - silicio rūgšties druskos. Silikato pramonė.
Iš viso 6 pristatymuose
Silicio yra esminis žemės plutos elementas, jis užima antrą po deguonies (apie 27,6%).
Silicio turi tris izotopus: I (92,27%); (4,68%); (3,05%).
Silicis egzistuoja dviem alotropiniais pakeitimais: amorfinis ir. \\ T crystal.. Struktūros skirtumas lemia šių pakeitimų fizinių savybių skirtumą. Amorfinis silicistas - Brown milteliai, neturi tam tikro lydymosi taško. Kristalinis silicistas išvaizda Atrodo, kad metalas, tamsiai pilkas su metaliniu blizgučiu, ugniai atspariu (lydymosi temperatūra 1400 ° C), tačiau jis nėra priskirtas metalams, nes jis yra trapus, jis šiek tiek atlieka elektros srovę ir manifestuoja cheminės savybės ne metalai.
Struktūra kristalinis silicistas Panašus į deimantų struktūrą. Savo kristale kiekvienas atomas yra susijęs su keturiomis kitomis kovalentinėmis obligacijomis. Be to, kovalentinis ryšys tarp silicio atomų yra daug silpnesnis nei tarp anglies atomų deimantų. Net ir įprastomis sąlygomis kai kurios jungtys yra sunaikintos ir atsiranda laisvi elektronai, kurie sukelia mažą elektros laidumą. Kai šildomas ir apšvietimas didėja destruktyvių obligacijų skaičius, todėl atsiranda daugiau nemokamų elektronų, didėja elektros laidumas.
"Crystal Silicon" - puslaidininkis. Puslaidininkių skambučių medžiagos, kurių elektrinis laidumas užima tarpinę vietą tarp metalų ir dielektrikų laidumo. Išsamiau išsamiai ištirs šį fenomeną fizikos pamokose vidurinėje mokykloje. Šioje nuosavybėje silicio naudojimas grindžiamas AC lygintuvų ir saulės kolektorių gamyboje, kuri konvertuoja saulės šiluminę energiją į elektrinį. Tokios baterijos yra įdiegtos dirbtiniuose žemės palydovuose, naudojami sausumos sąlygomis.
Įvairūs silicio (amorfinio ir kristalinio) struktūra nustato skirtingą alotropinių modifikacijų cheminę veiklą. Normaliomis sąlygomis kristalinis silicis yra inertiškas ir amorfinis nudegimas fluoriniu:

Kai silicis šildomas, jis sąveikauja su daugeliu metalų (deguonies, chloro, azoto, anglies, pilka), ir jis yra pažymėtas didelis skaičius Šilta. Silicis jungiasi su metalais. Šie junginiai vadinami silicidu.
Užduotis. Užduotis 1. Parašykite atitinkamas reakcijos lygtis ir nurodykite silicio funkcijas oksidacijos reakcijoms.
2 užduotis. Parašykite cheminių silicio reakcijų lygtis magnio, aliuminio. Nurodykite oksidatorių, mažinantį agentą. Išimkite oksidacijos laipsnį silicio.
Rūgštys (išskyrus skysčio HF) neveikia silicio, tačiau, kai audimas šarminio metalo metalo hidroksidai su silicio, silikato druska yra suformuotas - silikato ir vandenilio:
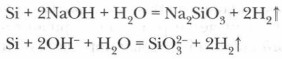
Esant aukštai temperatūrai, silicis atkuria daug metalų nuo jų oksidų:
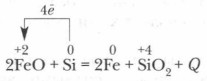
Grynoje formoje silicis nerandama.
Pirmą kartą 1822 m. Silicis buvo gautas Švedijos mokslininkas I. Berzelius, atkuriant silicio fluorido SIF 4 metalo kalio, kai šildomas iki 400 ° C temperatūroje. Tai dar lengviau gauti jį atkurti SIO 2 metalo magnio:
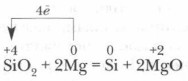
Silicio pramonėje jis paprastai gaunamas, kai šildomas smėlio ir kokso mišinys:
Susigrąžinta silicio iš dalies reaguoja su anglies pertekliais ir formomis carborundum. "Carborund" turi deimantų kristalų groteles, kovalentines obligacijas jame yra labai patvarus, todėl dėl kietumo jis yra artimas deimantui, naudojamas šlifavimo akmenų gamybai ir šlifavimo apskritimuose.
Užduotis. Kaip teisingai paskambinti SIC - silicio karbido ar anglies sylocide? Pateikti pagrįstą atsakymą.
Silicio derinys
Gamtoje silicis daugiausia yra silicio (smėlio) Sio 2 ir silikatų pavidalu. Švarus silicio oksido kristalai (IV) sudaro keletą polimorfinių modifikacijų, iš kurių kvarcas randamas kasybos kristalų pavidalu. Gražiai spalvoti kvarco kristalai (ametistas, dūminis topazas, juoda marijonas, karnenanas, agatas, opalas, jasperis ir kt.) Yra pusbrangiai akmenys.
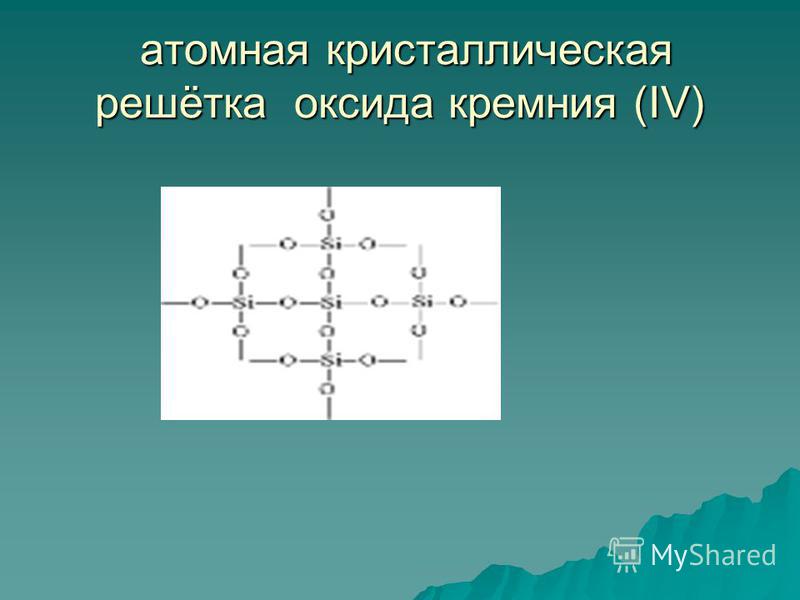
Silicio oksidas (IV) SIO 2 yra kieta ugniai atspari medžiaga (lydymosi temperatūra 1713 ° C), netirpsta vandenyje (54 pav.). Jis turi atomic. Crystal grotelės (55 pav.): Nėra molekulių, šalia kiekvieno silicio atomo yra keturi deguonies atomai - savotiškas erdvinis rėmas. Kvarcinis gabalas yra kaip viena milžiniška molekulė. Kvarcas yra neorganinis polimeras, jo formulė (SiO 2) n.
Čia galite atsisiųsti pamoką šia tema: "Anglies ir silicio pozicija periodinėje cheminių elementų sistemoje, jų atomų struktūroje. Anglies, alotropiniai modifikacijos" tema: chemija. Šis dokumentas padės jums parengti gerą ir aukštos kokybės medžiagą pamokai.
Data _____________ klasė _______________
Tema:Anglies ir silicio pozicija periodinėje cheminių elementų sistemoje, jų atomų struktūrai. Anglies, alotropiniai pakeitimai.
| Atomo pastato schema | Paskutinio energijos lygio elektroninė struktūra | Aukštojo oksido formulėRo. 2 | Lakių formulė. vandenio junginys Rh. 4 | |
| 1. Anglies | C.+6) 2 ) 4 | …2 s. 2 2 p. 2 | C. +4 O. 2 | C. -4 H. 4 |
| 2. Silicis | Si +14) 2 ) 8 ) 4 | …3 s. 2 3 p. 2 | Si +4 O. 2 | Si -4 H. 4 |
Kaip matyti iš atomų schemų, šių elementų išorės energijos lygiu yra 4 elektronai, todėl anglis ir silicis rodo oksidacijos laipsnį +4 ir -4.
Iš schemos galima matyti, kad anglies dvideginio garsumas turi du nesusijusius elektronus prie išorinio lygio (panašus į silicio). Tai paaiškina, kad anglis ir silicis gali turėti oksidacijos laipsnį +2 (pavyzdžiui, bendro - anglies monoksido). Pasukdami į sužadintą būseną, vienas iš s-elektronų gali eiti į nemokamą p-ofrbital. Tada atsiranda 4 nepasaitiniai elektronai ir oksidacijos laipsnis yra +4 ir - 4.
2. Keičiant savybes pogrupyje
Anglies pogrupyje su eilės skaičiumi padidėja, atominis branduolio mokestis didėja, elektronų skaičius išorinio lygio yra nuolat, energijos lygiai atomuose skaičius auga ir atomo spindulys padidėja nuo anglies į Švinas, neigiamų elektronų pritraukimas į teigiamą šerdį silpnina ir gebėjimas grįžti elektronų didėja, ir, taigi, anglies pogrupyje su sekos numerio padidėjimu, nemetalinės savybės sumažėjimas, ir metalas yra sustiprintas.
C ir si - nemetalai, GE - puslaidininkiai, SN ir PB - metalai.
Anglis. Altyrpopy anglis
Anglis yra gamtoje tiek laisvos formos ir jungtys. Potvynis randamas forma allotropiniai pakeitimai - deimantas, grafitas, karbinas, pilnas.
Deimantas
Kristalinė medžiaga, skaidri, labai refracts šviesos spinduliai yra labai sunkūs, neatlieka elektros srovės, jis netildo šilumos, ρ \u003d 3,5 g / cm3; T ° pl. \u003d 3730 ° C; T ° kip. \u003d 4830 ° C.
Galima gauti iš grafito P\u003e 50 tūkst. T ° \u003d 1200 ° C.
Taikymas:
Šlifavimo milteliai, grargai, stiklo pjaustytuvai, po pjaustymo - deimantai.
Grafitas
Kristalinė medžiaga, laminuota, nepermatoma, tamsiai pilka, turi metalinį blizgesį, minkštą, atlieka elektros srovę; ρ \u003d 2,5 g / cm 3.
Taikymas:
Elektrodai, pieštukai, neutroninis retarderis branduoliniuose reaktoriuose yra kai kurių tepalų dalis.
Karbin.
Juodi milteliai; ρ \u003d 2 g / cm 3; puslaidininkis.
Susideda iš linijinių grandinių -C≡C-C≡C- ir \u003d c \u003d c \u003d c \u003d c \u003d.
Kai šildomos pajamos į grafitą.
Pamoka

