Характеристика кремнію по періодичній системі
Характеристика по ПСХЕ 1. Положення в ПСХЕ. 1. Положення в ПСХЕ. 4 група, головна підгрупа, 4 група, головна підгрупа, 3 період.3 ряд 3 період.3 ряд Аr \u003d 28 Аr \u003d 28 ступінь окислення: ступінь окислення: -4, оксиди: оксиди: SiO (індиферентний) SiO (індиферентний) SiO 2 (кислотний) SiO 2 (кислотний) кислота кремнієва кислота кремнієва H 2 SiO 3 H 2 SiO 3
Z \u003d + 14 Z \u003d р \u003d 14 +1 р \u003d 14 0 n \u003d 28-14 \u003d 14 0 n \u003d 28-14 \u003d 14 е \u003d 14 е \u003d 14 + 14) 2) 8) 4 +14) 2) 8 ) S 2S 2P 3S 3P

Кремній є третім (після кисню і водню) по Кремній є третім (після кисню і водню) за поширеністю елементом: на його частку доводиться поширеності елементом: на його частку доводиться 16,7% від загального числа атомів земної кори. 16,7% від загального числа атомів земної кори. У природі кремній зустрічається тільки у вигляді діоксиду і солей кремнієвої кислоти (силікатів). Найбільш широко поширені алюмосилікати. У природі кремній зустрічається тільки у вигляді діоксиду і солей кремнієвої кислоти (силікатів). Найбільш широко поширені алюмосилікати.

Основні мінерали кремнію Основні мінерали кремнію Al 2 O 3 * 2SiO 2 * 2H 2 O - Біла глина Al 2 O 3 * 2SiO 2 * 2H 2 O -Біла глина K 2 O * Al 2 O 3 * SiO 2 - польовий шпат K 2 O * Al 2 O 3 * SiO 2 - польовий шпат K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - слюда K 2 O * Al 2 O 3 * 6SiO 2 * H 2 O - слюда SiO 2 -кремнезем або річковий пісок SiO 2 -кремнезем або річковий пісок

Кремній- головний елемент в царстві мінералів і гірських порід. Найчастіше він зустрічається у вигляді мінералів кварцу (різновиди якого-кремінь, кремнезем (пісок), агат, яшма) і гірського кришталю, (різновидами якого є: аметист, димчастий топаз). Кремній- головний елемент в царстві мінералів і гірських порід. Найчастіше він зустрічається у вигляді мінералів кварцу (різновиди якого-кремінь, кремнезем (пісок), агат, яшма) і гірського кришталю, (різновидами якого є: аметист, димчастий топаз). У вільному вигляді кремній майже не зустрічається. У вільному вигляді кремній майже не зустрічається.

Деякі морські організми накопичують кремній у великих кількостях. Деякі морські організми накопичують кремній у великих кількостях. До багатих їм морським рослинам відносять діатомові водорості, з тварин-багато кремнію містять радіолярії, кремнієві губки. До багатих їм морським рослинам відносять діатомові водорості, з тварин-багато кремнію містять радіолярії, кремнієві губки.

А. в промисловості - відновлення вугіллям в електричних печах а. в промисловості - відновлення вугіллям в електричних печах SiO 2 + 2С \u003d Si + 2CO SiO 2 + 2С \u003d Si + 2CO б. в лабораторії - відновлення металами кремнезему б. в лабораторії - відновлення металами кремнезему 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3 3SiO 2 + 4Al \u003d 3Si + 2Al 2 O 3

1) аморфний кремній - бурий порошок 1) аморфний кремній - бурий порошок t плавлення 1420 С. t плавлення 1420 С. 2) кристалічний кремній - тверда речовина, темно-сірого кольору зі слабким металевим блиском, має тепло-і електропровідністю 2) кристалічний кремній - тверда речовина, темно-сірого кольору зі слабким металевим блиском, має тепло і електропровідність

А) взаємодія з простими речовинами. а) взаємодія з простими речовинами. Si-відновник Si-відновник 1) з галогенами 1) з галогенами Si + 2F 2 \u003d SF 4 - фторид кремнію Si + 2F 2 \u003d SF 4 - фторид кремнію 2) з киснем 2) з киснем Si + O 2 SiO 2-оксиди кремнію (lV) Si + O 2 SiO 2-оксиди кремнію (lV) 3) з азотом 3) з азотом 3Si + 2N 2 \u003d Si 3 N 4 -нітрід кремнію 3Si + 2N 2 \u003d Si 3 N 4 -нітрід кремнію 4) з вуглецем 4) з вуглецем Si + C \u003d SiC карбід кремнію або Si + C \u003d SiC карбід кремнію або карборунд карборунд

Si-окислювач Si-окислювач 5) з металами 5) з металами Si + 2Mg \u003d t Mg 2 Si -сіліцід магнію Si + 2Mg \u003d t Mg 2 Si -сіліцід магнію Безпосередньо з воднем кремній не реагує. Безпосередньо з воднем кремній не реагує. SiH 4 отримують непрямим шляхом. SiH 4 отримують непрямим шляхом. Mg 2 Si + 4HCl \u003d 2MgCl 2 + SiH 4 Mg 2 Si + 4HCl \u003d 2MgCl 2 + SiH 4 (силан, отруйний газ) (силан, отруйний газ)

Б) взаємодія зі складними речовинами 1) з галогеноводородов реакція йде тільки з HF 1) з галогеноводородов реакція йде тільки з HF Si + 4HF \u003d SiF 4 + 2H 2 Si + 4HF \u003d SiF 4 + 2H 2 2) з кислот реакція йде тільки зі сумішшю азотної і плавикової 2) з кислот реакція йде тільки з сумішшю азотної і плавикової 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O 3Si + 12HF + 4HNO 3 \u003d 3SiF 4 + 4NO + 8H 2 O При дії інших кислот на поверхні кремнію утворюється щільна оксидна плівка SiO 2 При дії інших кислот на поверхні кремнію утворюється щільна оксидна плівка SiO 2 3) взаємодія з лугами 3) взаємодія з лугами Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2 Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2

Відкриття. У 1834 році російський хімік Гесс дав цьому елементу російська назва. У 1834 році російський хімік Гесс дав цьому елементу російська назва. Кремній був кремній був відкритий в 1825 році відкрито в 1825 році шведським хіміком шведським хіміком Берцеліусом. Берцелиусом.

Застосування Застосовується в техніці для отримання напівпровідникових матеріалів і сплавів. Так само для отримання скла і цементу, різців для метало - ріжучих верстатів. Застосовується в техніці для отримання напівпровідникових матеріалів і сплавів. Так само для отримання скла і цементу, різців для метало - ріжучих верстатів.

Оксид кремнію (IV) або кремнезем Оксид кремнію (IV) або кремнезем 1. Будова: Оксид кремнію (IV) має не молекулярну (як у вуглекислого газу), а атомну кристалічну решітку 1. Будова: Оксид кремнію (IV) має не молекулярну ( як у вуглекислого газу), а атомну кристалічну решітку Тому SiO 2 тверде і тугоплавка речовина, Тому SiO 2 тверде і тугоплавка речовина, Яке не розчиняється у воді і кислотах, крім плавикової (згадай галогеноводородних кислоти). Яке не розчиняється у воді і кислотах, крім плавикової (згадай галогеноводородних кислоти).




Учитель хімії: Малиновська Юлія Владиславівна
Конспект уроку на тему: «Положення вуглецю і кремнію в періодичній системі хімічних елементів, порівняльна характеристика цих елементів. Аллотропия вуглецю. »
клас: 9 клас
мета: створити умови для систематизації і поглиблення знань учнів про будову атомів, взаємозв'язку складу - будівлі - властивостей речовин
завдання:
освітні:
Узагальнення і поглиблення знань учнів про будову атомів в залежності від положення в періодичній системі; взаємозв'язку складу - будівлі - властивостей речовин на прикладі аллотропних модифікацій вуглецю
Розширення загальнокультурного кругозору учнів
Розвиток умінь аналізувати, порівнювати, робити висновки, встановлювати взаємозв'язки
Розкриття світоглядної ідеї про взаємозв'язок складу, будови, властивостей речовин; виховання інтелектуально розвиненої особистості; виховання культури спілкування
^ Тип уроку: По дидактичної мети - вдосконалення та застосування знань; за способом організації - застосування знань і ознайомлення з новим матеріалом
Використовувані освітні технології:
Інформаційні
Технологія актуалізації особистого досвіду
Технологія орієнтації на пізнавальний розвиток особистості
форма проведення: Поєднання бесіди, самостійної діяльності
устаткування: комп'ютер, проектор, комп'ютерна презентація, колекція: «Види вугілля», зразки кристалічних решіток алмазу і графіту.
^ 1 етап уроку
Організаційний. Оголошення теми уроку.
Вітаю! Сьогодні на уроці ми будемо говорити про двох хімічних елементах.
Назви цих елементів походить від латинських слів «карбо» і «ляпіс креманс». (Учні відразу розуміють, що мова піде про вуглець і кремній.).
«Карбо» - «карбонеум» - означає «вугілля» - вуглець, а «ляпіс креманс» - камінь, що дає вогонь - кремній.
Сьогодні на уроці нам необхідно буде дати порівняльну характеристику цих елементів, використовуючи раніше отримані знання.
У зошитах учні записують тему уроку: « Порівняльна характеристика елементів вуглецю і кремнію ».
Порівняти, значить вибрати в першу чергу, критерії порівняння. Скажіть, будь ласка, які критерії ми, на вашу думку, повинні порівнювати. Учні відповідають: положення в ПС, будова атомів, валентні можливості, ступеня окислення і т.п.
^ 2 етап уроку
Використовуючи знання про будову атомів, характеристиці елементів по положення в ПС, учні самостійно заповнюють порівняльну таблицю № 1.
Таблиця № 1. Порівняльна характеристика елементів вуглецю і кремнію
| ^ критерії порівняння | З вуглець | Si кремній |
| Положення в ПС | 2 період, IV група, головна підгрупа (А) | 3 період, IV група, головна підгрупа (А) |
| будова атомів | Z я \u003d + 6, р \u003d 6, е \u003d 6, n \u003d 12-6 \u003d 6, зовнішні е \u003d 4 | Z я \u003d + 14, р \u003d 14, е \u003d 14, n \u003d 28-14 \u003d 14, зовнішні е \u003d 4 |
| Електронна конфігурація атомів | 1s 2 2s 2 2p 2 | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| валентні можливості | II в стаціонарному стані IV в збудженому стані |
|
| Можливі ступені окислення | від -4 до +4 СН 4, С 2 Н 6, С 2 Н 4, Сас 2, С, З 2 F 2, СО, С 2 F 6, СО 2 | -4, 0, +2, +4 Mg 2 Si, Si, SiO, SiO 2 |
| радіус атома | зростає |
|
| Електронегативність (за шкалою Полінга) | 2,5 | 1,9 |
| Формула вищого оксиду, його характер, назва | СО 2 - кислотний, оксид вуглецю (IV), вуглекислий газ, діоксид вуглецю | SiO 2 - кислотний, оксид кремнію (IV) |
| Формула вищого гідроксиду, його характер, назва | H 2 CO 3 - слабка нестійка кислота (СО 2 + H 2 O), солі - карбонати | H 2 SiO 3 - слабка кислота, має полімерну структуру (SiO 2 nH 2 O), солі - силікати |
| водневе з'єднання | СН 4 - метан | SiН 4 - силан (нестійкий) |
| В природі | Необхідний елемент органічних речовин | Найбільш поширений (після кисню) елемент земної кори |
Після закінчення самостійної роботи по заповненню таблиці, все разом з учителем заповнюють заздалегідь написану на дошці таблицю. У процесі спільного заповнення учні разом з учителем відзначають, промовляють деякі особливості елементів, на які необхідно звернути увагу:
Майже у всіх своїх сполуках вуглець і кремній чотирьохвалентного, тобто атоми цих елементів знаходяться в збудженому стані. Учитель (учень) показує це на дошці:
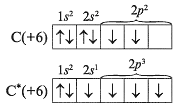
Різноманітність ступенів окислення у атомів вуглецю обумовлено існуванням органічних сполук, В неорганічних речовинах його найбільш характерні ступені окислення: -4, 0, +2, +4
Характерною відмінністю вуглецю і кремнію є здатність вуглецю до цепеобразованію. Атоми вуглецю, з'єднуючись один з одним, утворюють стійкі з'єднання, аналогічні сполуки кремнію нестійкі.
^ 3 етап уроку
Від характеристики хімічних елементів - до простих речовин.
Робота з комп'ютерною презентацією.
Для атомів вуглецю характерна аллотропия. Учні згадують визначення поняттю - «аллотропия». Учитель запитує: «У будь раніше пройдених хімічних елементів є аллотропние модифікації?».
Учні наводять приклади: елемент кисень (О) - О2 - кисень, О3 - озон; елемент сірка (S) - кристалічна і пластична сірка.
Далі вчитель запитує учнів, може бути їм відомі аллотропние модифікації вуглецю.
Вуглець існує в формі наступних простих речовин: алмаз, графіт, карбін, фулерен. Вугілля, сажу можна розглядати як різновиду графіту.
Інтерес представляє деревне вугілля.
З ним був знайомий ще первісна людина: він знаходив його на місцях згарищ і після розводяться їм багать. Деревне вугілля має великий пористість і не тоне. У 1785 р вчений - хімік Товій Ловиц ненавмисно пролив винну кислоту (бурого кольору через домішок) на суміш піску з вугіллям. Ловиц зібрав пролився розчин, отфильтровал його від піску з вугіллям. У фільтрі залишилося безбарвна речовина. Виявилося, що вугілля поглинув домішки, що містяться у винній кислоті. Так було відкрито явища, яке називають адсорбцією.
адсорбція - властивості вугілля та інших твердих речовин утримувати на своїй поверхні гази і розчинені речовини. Речовини, на поверхні яких відбувається адсорбція, називають адсорбентами.
Адсорбція вугілля обумовлюється його пористістю. Чим більше часу, тим краще сорбционная здатність вугілля. Але, звичайно, пори вугілля заповнені різними речовинами. Щоб їх очистити, вугілля нагрівають в струмені водяної пари. Таке вугілля, з очищеними порами, називають активованим.
В першу світову війну, Явище адсорбції знайшло застосування в боротьбі з бойовими отруйними речовинами. Хлор (задушливий газ) був застосований в 1915 році на західному фронті біля міста Ипра проти англо-французьких військ. Атака хлором позбавила боєздатності цілу дивізію (15 тис чол були виведені з ладу, 5 тис - загинули).
Російський професор Микола Зелінський (пізніше академік) винайшов і провів випробування в липні 1915 р протигаза, чинного на основі явища адсорбції.
Кремній утворює проста речовина - кристалічний кремній. Існує так само аморфний кремній - порошок білого кольору.
Далі вчитель зупиняється і позначає фізичні властивості кожного простого речовини, Утвореного атомами вуглецю (слайди).
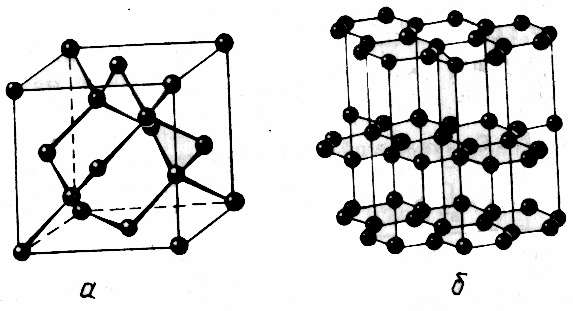
Учитель звертає увагу учнів на те, що алмаз і графіт, що складаються з атомів вуглецю, мають такі різні фізичні властивості. Чому? (Не завжди учні можуть дати відповідь на це питання). Учитель звертає увагу на різну будову кристалічних решіток алмазу і графіту.
У кристалі алмаза кожен атом вуглецю утворює чотири міцні ковалентні зв'язки, вони спрямовані до вершин тетраедра, всі відстані між атомами однакові. У графіті ж відстань між атомами в шарі набагато менше, ніж відстань між шарами (зразки кристалічних решіток).
^ 4 етап уроку
Його мета: розширення загальнокультурного кругозору учнів, встановлення міжпредметних зв'язків хімії з історією.
На попередньому уроці, як домашнього завдання, Вчитель запропонував учням знайти цікаві факти про історію алмаза і підготувати виступ з комп'ютерною презентацією.
Якщо є учні, які виконали завдання, вчитель надає їм слово, якщо немає, то розповідає сам і показує свою презентацію.
^ 5 етап уроку
Підведення підсумків. Рефлексія.
Учні відповідають на питання:
Які нові поняття були вивчені на уроці?
Які питання викликали труднощі? І т.п.
Учитель ставить оцінки тим, учням, які показали хороші і відмінні знання в процесі уроку, були активні.
Список літератури:
Льовкін А.Н. Загальна і неорганічна хімія: матеріали до іспитів. - СПб .: «Паритет», 2003 - 240 с.
Малиновська Ю.В. Хімія. 6-й клас / Пропедевтичний курс. - СПб .: ТОВ Фірма «Ікар», 2002 - 76 с.
Таубе П. Р., Руденко О. І. Від водню до нобелия? - М .: державної реєстрацiї. вид-во « вища школа», 1961 - 330 с.
Хімія: підручник для 9 кл.общеобразоват. уч. / Рудзитис Г.Є., Фельдман Ф.Г. - 11 - е изд. Пере. - М .: Просвещение 2010
Порядковий номер - 14, заряд ядра +14, протонів в ядрі - 14, електронів - 14. Номер періоду III - 14 електронів рухаються по трьом енергетичним рівням. Номер групи IV - на зовнішньому енергетичному рівні знаходяться 4 електрона. Радіус атома більше ніж у вуглецю - збільшується здатність до віддачі електронів. Збільшуються металеві і відновні властивості (в порівнянні з вуглецем). Si Ge Sn Pb. Загальна характеристика кремнію за положенням у періодичній системі. C.
Картинка 2 з презентації «Кремній» до уроків хімії на тему «Кремній»Розміри: 960 х 720 пікселів, формат: jpg. Щоб безкоштовно завантажити картинку для уроку хімії, клацніть по зображенню правою кнопкою мишки і натисніть «Зберегти зображення як ...». Для показу картинок на уроці Ви також можете безкоштовно скачати презентацію «Кремній.ppt» цілком з усіма картинками в zip-архіві. Розмір архіву - 562 КБ.
завантажити презентаціюкремній
«Урок Кремній» - Вуглекислий газ про себе і людство. Робота в парах, взаимопроверка - немає помилок (5), дві помилки-(4), і т.д. 3% в повітрі - запаморочення, шум у вухах, сонливість. 20% -смертельно для людини. Про прояві неметалевих і металевих властивостей. Командна оцінка. Що можна сказати про розмір радіусів атомів від вуглецю до свинцю?
«Кремній та його сполуки» - Розглянути природні сполуки кремнію. Дати загальну характеристику елементу кремній. Отримання кремнію. Кремній був вперше відкритий в 1811 році Гей-Люссак і Тенаром. Будова і властивості атомів. Оксид кремнію на відміну від оксиду вуглецю (IV) з водою не взаємодіє. Напівпровідник. Tплав (Si) \u003d 1415? C, Tплав (алмаз) \u003d 3730? C.
«Ізотопи кремнію» - Отримання полікрісталлічес-кого кремнію. Залежність положення максимуму смуги комбінаційного розсіювання від атомної маси. Пальник. Виготовлення монокристаллической затравки. Зонноочіщенний кремній. Захисне покриття. Теплопровідність ізотопнообогащенного кремнію-28. Вирощування монокристалів. Розподіл концентрації ізотопів по довжині затравки.
«З'єднання кремнію» - Різновиди кварцу. Яшма. Отримання силікатів. Природні силікати. Оксид кремнію. Мінерали на основі SiO2. Хімічні властивості SiO2. Відкриття кремнію. Кремній та його сполуки. Кремній. Агат. Ступінь окислення. Електронна конфігурація. Силікати і водень. Гірський кришталь. Знаходження в природі. Сілан.
«Вуглець і кремній» - Хімічні властивості. Одне з найбільш м'яких серед твердих речовин. Силікатних цегли. Така суміш називається генераторним газом. Рис.1 Модель решітки алмазу. Добутий газ складається з вільного азоту і оксиду вуглецю (II). Більше 99% вуглецю в атмосфері міститься у вигляді вуглекислого газу. Положення в ПСХЕ.
«Кремній» - До завершення зовнішнього рівня кремнію не вистачає 4 електронів. Оксид кремнію (IV). Загальна характеристика кремнію за положенням у періодичній системі. У лабораторіях кремній отримують, відновлюючи оксид кремнію SiO2. Фізичні властивості. Силікати - солі кремнієвої кислоти. Силікатна промисловість.
Всього в темі 6 презентацій
Кремній - найважливіший елемент земної кори, за поширеністю він займає друге місце після кисню (приблизно 27,6%).
Кремній має три ізотопи: i (92,27%); (4,68%); (3,05%).
Кремній існує в двох аллотропних модифікаціях: аморфний і кристалічний. Різниця в будові обумовлює і відмінність у фізичних властивостях цих модифікацій. аморфний кремній - бурий порошок, не має певної температури плавлення. Кристалічний кремній по зовнішнім виглядом схожий на метал, темно-сірого кольору з металевим блиском, тугоплавок (температура плавлення 1400 ° С), але до металів його не відносять, так як він крихкий, слабо проводить електричний струм і проявляє хімічні властивості неметалів.
структура кристалічного кремнію аналогічна структурі алмазу. У його кристалі кожен атом з'єднаний з чотирма іншими ковалентними зв'язками. Причому ковалентний зв'язок між атомами кремнію значно слабкіше, ніж між атомами вуглецю в алмазі. Навіть при звичайних умовах частина зв'язків руйнується і з'являються вільні електрони, які обумовлюють невелику електричну провідність. При нагріванні і висвітленні число руйнуються зв'язків зростає, отже, з'являється більше вільних електронів, збільшується електрична провідність.
Кристалічний кремній - напівпровідник. Напівпровідниками називають речовини, електрична провідність яких займає проміжне місце між провідністю металів і діелектриків. Більш детально ви будете вивчати це явище на уроках фізики в старших класах. На цьому властивості грунтується застосування кремнію при виготовленні випрямлячів змінного струму і сонячних батарей, що перетворюють теплову енергію сонця в електричну. Такі батареї встановлюються на штучних супутниках Землі, використовуються і в наземних умовах.
Різну будову кремнію (аморфного і кристалічного) обумовлює і різну хімічну активність аллотропних модифікацій. При звичайних умовах кристалічний кремній інертний, а аморфний згорає у фторі:

При нагріванні кремній взаємодіє з багатьма неметалами (киснем, хлором, азотом, вуглецем, сіркою), і при цьому виділяється велика кількість теплоти. Кремній з'єднується з металами. Ці сполуки називаються силіцидом.
Завдання. Завдання 1. Напишіть відповідні рівняння реакцій і вкажіть функції кремнію в окисно-відновних реакціях.
Завдання 2. Напишіть рівняння хімічних реакцій кремнію з магнієм, алюмінієм. Вкажіть окислювач, відновник. Зробіть висновок, який ступінь окислення виявляє кремній.
Кислоти (крім плавикової HF) на кремній не діють, однак при сплаву гідроксидів лужних металів з кремнієм утворюється сіль кремнієвої кислоти - силікат і водень:
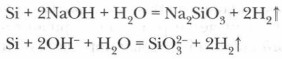
При високій температурі кремній відновлює багато метали з їх оксидів:
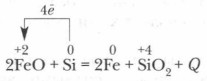
У чистому вигляді кремній в природі не зустрічається.
Вперше кремній був отриманий в 1822 р шведським вченим І. Берцелиусом шляхом відновлення фториду кремнію SiF 4 металевим калієм при нагріванні до 400 ° С. Ще легше його отримати відновленням SiO 2 металевим магнієм:
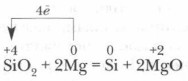
У промисловості кремній отримують зазвичай при нагріванні суміші піску і коксу:
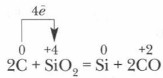
Відновлений кремній частково реагує з надлишком вуглецю, і утворюється карборунд Карборунд має алмазоподобную кристалічну решітку, ковалентні зв'язки в ній дуже міцні, тому по твердості він близький до алмазу, використовується для виготовлення точильних каменів і шліфувальних кругів.
Завдання. Як правильно називати SiC - карбідом кремнію або силіцидом вуглецю? Дайте обґрунтовану відповідь.
з'єднання кремнію
У природі кремній знаходиться переважно у вигляді кремнезему (піску) SiO 2 і силікатів. Чисті кристали оксиду кремнію (IV) утворюють кілька поліморфних модифікацій, одна з яких кварц, зустрічається у вигляді гірського кришталю. Красиво забарвлені кристали кварцу (аметист, димчастий топаз, чорний моріон, сердолік, агат, опал, яшма та ін.) Є напівдорогоцінним камінням.
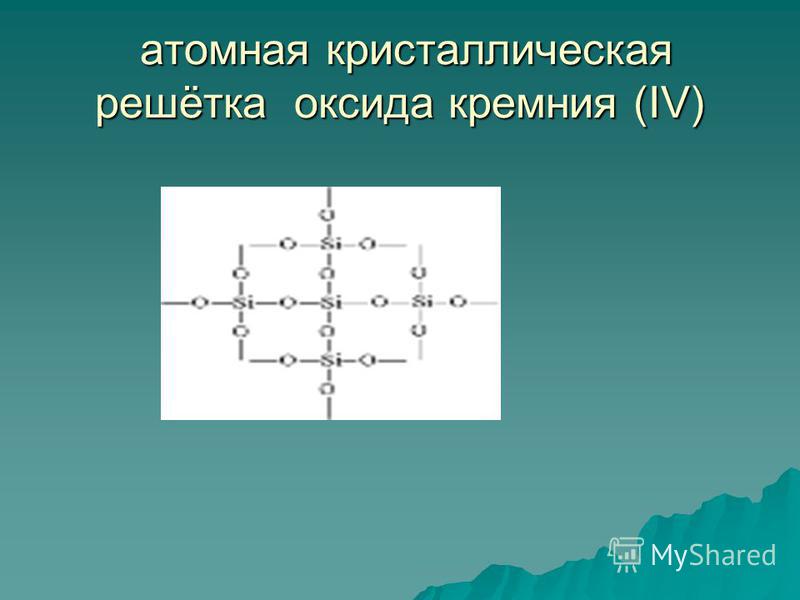
Оксид кремнію (IV) SiO 2 - тверде тугоплавка речовина (температура плавлення 1713 ° С), нерозчинний у воді (рис. 54). він володіє атомної кристалічною решіткою (рис. 55): тут немає молекул, біля кожного атома кремнію розташовуються чотири атома кисню - утворюється своєрідний просторовий каркас. Шматок кварцу є як би одну гігантську молекулу. Кварц - неорганічний полімер, його формула (SiO 2) n.
Тут Ви можете завантажити Урок по темі: "Положення вуглецю і кремнію в періодичній системі хімічних елементів, будова їх атомів. Вуглець, аллотропние модифікації" для предмета: Хімія. Даний документ допоможе вам підготувати хороший і якісний матеріал для уроку.
Дата _____________ Клас _______________
Тема:Положення вуглецю і кремнію в періодичній системі хімічних елементів, будова їх атомів. Вуглець, аллотропние модифікації.
| Схема будови атома | Електронна будова останнього енергоуровня | Формула вищого оксидуRO 2 | Формула летючого водневого з'єднання RH 4 | |
| 1. Вуглець | C+6) 2 ) 4 | …2 s 2 2 p 2 | C +4 O 2 | C -4 H 4 |
| 2. Кремній | Si +14) 2 ) 8 ) 4 | …3 s 2 3 p 2 | Si +4 O 2 | Si -4 H 4 |
Як видно з схем будови атомів, на зовнішньому енергетичному рівні цих елементів знаходиться 4 електрона, тому, вуглець і кремній виявляють ступінь окислення +4 і -4.
Зі схеми видно, що у тому вуглецю два неспарених електрона на зовнішньому рівні (аналогічно і у кремнію). Цим пояснюється, що вуглець і кремній можуть мати ступінь окислення +2 (Наприклад, СО - чадний газ). Переходячи в збуджений стан, один з s-електронів може перейти на вільну p орбіталь. Тоді в атомах з'являється 4 неспарених електрона і ступінь окислення дорівнює +4 і - 4.
2. Зміна властивостей в підгрупі
У підгрупі вуглецю з ростом порядкового номера заряд ядра атомів збільшується, число електронів на зовнішньому рівні постійно, число енергетичних рівнів в атомах росте і радіус атома збільшується від вуглецю до свинцю, тяжіння негативних електронів до позитивного ядра слабшає і здатність до віддачі електронів збільшується, і, отже, в підгрупі вуглецю з ростом порядкового номера неметалічні властивості убувають, а металеві посилюються.
З і Si - неметали, Ge - напівпровідник, Sn і Pb - метали.
ВУГЛЕЦЬ. АЛЛОТРПОПІЯ ВУГЛЕЦЮ
Вуглець зустрічається в природі , Як у вільному вигляді, так і в з'єднаннях. У вільному вигляді зустрічається в вигляді аллотропних видозмін - алмаз, графіт, карбін, фулерен.
алмаз
Кристалічна речовина, прозоре, сильно переломлює промені світла, дуже тверде, не проводить електричний струм, погано проводить тепло, ρ \u003d 3,5 г / см 3; t ° пл. \u003d 3730 ° C; t ° кип. \u003d 4830 ° C.
Можна отримати з графіту при p\u003e 50 тис. Атм; t ° \u003d 1200 ° C.
застосування:
Шліфувальний порошок, бури, склорізи, після ограновування - діаманти.
графіт
Кристалічна речовина, шаруваті, непрозоре, темно-сіре, володіє металевим блиском, м'яке, проводить електричний струм; ρ \u003d 2,5 г / см 3.
застосування:
Електроди, олівцеві грифелі, сповільнювач нейтронів в ядерних реакторах, входить до складу деяких мастильних матеріалів.
Карбин
Чорний порошок; ρ \u003d 2 г / см 3; напівпровідник.
Складається з лінійних ланцюжків -C≡C-C≡C- і \u003d С \u003d С \u003d С \u003d С \u003d.
При нагріванні переходить в графіт.
урок

