Caractéristique de silicium sur le système périodique
Caractéristiques de la PSHE 1. Position dans PSHE. 1. Position dans PSHE. 4 Groupe, Sous-groupe à domicile, 4 Groupe, Sous-groupe à domicile, 3 Période 3 Rild 3 Période 3 Période 3 Rail Ar \u003d 28 AR \u003d 28 Degré d'oxydation: Oxydation Diplôme: -4, Oxydes: Oxydes: Sio (indifférent) SiO 2 (acidic) SiO 2 (acide) acide-volé acide-volé H 2 SiO 3 H 2 SiO 3
Z \u003d + 14 z \u003d p \u003d 14 +1 p \u003d 14 0 n \u003d 28-14 \u003d 14 0 n \u003d 28-14 \u003d 14 E \u003d 14 E \u003d 14 +14) 2) 8) 4 +14) 2) 8 ) S 2S 2P 3S 3P

Le silicium est le troisième (après l'oxygène et l'hydrogène) dans le silicium est le troisième (après l'oxygène et l'hydrogène) dans la prévalence de l'élément: sa part doit être répandue avec un élément: il s'agit de 16,7% du nombre total d'atomes d'écorce terrestre. 16,7% du nombre total d'atomes d'écorce terrestre. Dans la nature, le silicium se trouve uniquement sous la forme de dioxydes et sels de l'acide silicique (silicates). Les aluminosilicates sont les plus répandus. Dans la nature, le silicium se trouve uniquement sous la forme de dioxydes et sels de l'acide silicique (silicates). Les aluminosilicates sont les plus répandus.

Minerals principaux Minicon Minicon Minicon Minicon Minicon Al 2 O 3 * 2SIO 2 * 2H 2 O - argile blanche AL 2 O 3 * 2SIO 2 * 2H 2 O - Argile blanche K 2 O * AL 2 O 3 * SiO 2 - Champ PLUM K 2 O * AL 2 O 3 * SiO 2 - Champ PLUM K 2 O * AL 2 O 3 * 6 ssio-2 * h 2 o - mica K 2 O * AL 2 O 3 * 6 ssio 2 * H 2 O - SiO 2 SYDA 2 -ReMbling ou rivière SiO 2 sable ou sable de la rivière

Le silicium est l'élément principal du royaume de minéraux et de roches. Le plus souvent, on se trouve sous la forme de minéraux de quartz (dont les variétés - silex, silice (sable), agate, jaspe) et cristal de montagne (dont les variétés sont: améthyste, topaze fumée). Le silicium est l'élément principal du royaume de minéraux et de roches. Le plus souvent, on se trouve sous la forme de minéraux de quartz (dont les variétés - silex, silice (sable), agate, jaspe) et cristal de montagne (dont les variétés sont: améthyste, topaze fumée). Fréquemment, le silicium n'est presque jamais trouvé. Fréquemment, le silicium n'est presque jamais trouvé.

Certains organismes marins accumulent des silicium en grande quantité. Certains organismes marins accumulent des silicium en grande quantité. Pour leurs riches plantes marines comprennent les diatomes d'algues, des animaux, beaucoup de silicium contiennent des radiolles, des éponges de silicium. Pour leurs riches plantes marines comprennent les diatomes d'algues, des animaux, beaucoup de silicium contiennent des radiolles, des éponges de silicium.

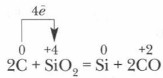
A. Dans l'industrie - restauration du charbon dans des fours électriques a. Dans l'industrie - la réduction du charbon dans des fours électriques SiO 2 + 2C \u003d Si + 2CO SIO 2 + 2C \u003d Si + 2CO b. En laboratoire - la réduction des métaux de silice b. En laboratoire - la restauration des métaux de silice 3Sio 2 + 4Al \u003d 3Si + 2 O2 2 O 3 3Sio 2 + 4Al \u003d 3SI + 2 OA 2 O 3

1) Silicon amorphe - poudre brun 1) silicium amorphe - poudre brun en fusion 1420 C. T fusion 1420 pp. 2) Silicon cristallin - Solide, couleur gris foncé avec paillettes métalliques faibles, conductivité de chaleur et électrique 2) silicium cristallin - Solide, gris foncé avec une paillettes métalliques faibles, a la chaleur et la conductivité électrique

A) interaction avec des substances ordinaires. a) interaction avec des substances ordinaires. Agent SI-Réducteur SI-Réducteur Agent 1) avec halogènes 1) avec Si + 2F 2F 2 \u003d SF 4 - fluorure de silicium SI + 2F 2 \u003d SF 4 - Fluorure de silicium 2) avec oxygène 2) avec oxygène sio + o 2 sio 2 -Oxyde silicium (LV) SI + O 2 SIO Silicon 2-oxyde (LV) 3) avec de l'azote 3) avec de l'azote 3Si + 2N 2N 2 \u003d Si 3 Nitrure de silicium 3Si + 2N 2 \u003d Si 3 N-Nitride Silicon 4 ) Avec carbone 4) avec carbone Si + C \u003d SIC-carbone Silicon ou Si + C \u003d SIC-KARBIDE Silicium ou Carborund Carborund

Agent Si-oxydant SI-oxydant 5) avec métaux 5) avec métaux SI + 2MG \u003d T mg 2 Si -Silicide MAGNESIUM MAGNESIUM SI + 2MG \u003d T MG 2 SI -Silicide Le magnésium directement avec de l'hydrogène de silicium ne répond pas. Directement avec de l'hydrogène de silicium ne réagit pas. Sih 4 est obtenu indirectement. Sih 4 est obtenu indirectement. MG 2 SI + 4HCL \u003d 2MGCl 2 + Sih 4 mg 2 Si + 4HCL \u003d 2MGCl 2 + SiH 4 (Silwn, gaz toxique) (Silwn, Poison Gaz)

B) Interaction avec des substances complexes 1) des réactions d'hydrogène halogène uniquement avec HF 1) à partir d'éleveurs halogènes La réaction est uniquement avec HF SI + 4HF \u003d SIF 4 + 2H2 SI + 4HF \u003d SIF 4 + 2H 2 2) d'acides un mélange de nitrique et fluide 2) d'acides. La réaction est uniquement avec un mélange d'azote et de fluide 3Si + 12HF + 4HNO 3 \u003d 3SIF 4 + 4NO + 8H 2 O 3Si + 12HF + 4HNO 3 \u003d 3SIF 4 + 4NO + 8H 2 O Sous l'action d'autres acides, un film d'oxyde dense SiO 2 est formé sur la surface de silicium sous l'action d'autres acides sur la surface de silicium, un film d'oxyde dense SiO 2 3 est formé) Interaction alcaline 3) Interaction avec alcalis Si + 2naOH + H 2 O \u003d Na 2 SiO 3 + 2H 2 SI + 2NAOH + H 2 O \u003d NA 2 SiO 3 + 2H 2

Ouverture. En 1834, le chimiste russe a donné cet élément au nom russe. En 1834, le chimiste russe a donné cet élément au nom russe. Silicon était le silicium a été ouvert en 1825, il a été ouvert en 1825 par le chimiste chimiste suédois suédois Berzelius. Berzelius.

L'application est utilisée dans la technique pour obtenir des matériaux semi-conducteurs et des alliages. Aussi pour obtenir du verre et du ciment, des coupeurs pour des machines de coupe en métal. Il est utilisé dans la technique pour obtenir des matériaux et des alliages semi-conducteurs. Aussi pour obtenir du verre et du ciment, des coupeurs pour des machines de coupe en métal.

Oxyde de silicium (IV) ou silice silice (IV) ou silice 1. Bâtiment: l'oxyde de silicium (IV) n'a pas de moléculaire (comme du dioxyde de carbone) et un réseau cristallin nucléaire 1. Construction: l'oxyde de silicium (IV) n'a pas de moléculaire (comme Dioxyde de carbone) et le réseau cristallin atomique de la substance solide et réfractaire SiO 2, donc la substance solide SIO 2 qui ne se dissolve pas dans l'eau et les acides, à l'exception du fluide (rappelez-vous d'acides chlorhydoriques halogènes). Ce qui n'est pas dissous dans l'eau et les acides, à l'exception de l'emballage (rappelez-vous les acides d'élevage halogène).




Professeur de la chimie: Malinovskaya Julia Vladislavovna
Une leçon abstraite sur le sujet: "La position de carbone et de silicium dans un système périodique d'éléments chimiques, caractéristiques comparatives de ces éléments. Allotropie du carbone. "
Classer: 9e année.
Objectif: Créer des conditions pour la systématisation et l'approfondissement de la connaissance des étudiants sur la structure des atomes, la relation de la composition - la structure - Propriétés des substances
Tâches:
Éducatif:
Généralisation et approfondir la connaissance des étudiants sur la structure des atomes en fonction de la position du système périodique; La relation de la composition est la structure - Propriétés des substances de l'exemple de modifications carbone altéropiques
Expansion de la structure générale des étudiants
Développement de compétences pour analyser, comparer, tirer des conclusions, établir des relations
Divulgation de l'idée idéologique de la relation de la composition, de la structure, des propriétés des substances; Éducation d'une personnalité développée intellectuellement; Education de la culture de la communication
^ Type de leçon: Selon l'objectif didactique - l'amélioration et l'application des connaissances; Selon la méthode de l'organisation - l'utilisation de connaissances et de familiarisation avec le nouveau matériel
Technologies éducatives utilisées:
Informations
Technologie d'expérience personnelle
Technologie d'orientation pour le développement de l'identité cognitive
Forme de: Combinaison de conversation, activités indépendantes
Équipement: Ordinateur, projecteur, présentation informatique, collection: "Types de charbon", échantillons de réseaux de cristaux de diamant et de graphite.
^ 1 cours de scène
Organisationnel. Annonce des sujets de cours.
Bonjour! Aujourd'hui dans la leçon, nous parlerons de deux éléments chimiques.
Les noms de ces éléments proviennent des mots latins "carbo" et "lyapis sremyns". (Les étudiants comprennent immédiatement qu'il s'agira de carbone et de silicium.).
"Carbo" - "carbonum" - signifie "charbon" - carbone et "lyapis sremyns" est une pierre qui donne feu - silicium.
Aujourd'hui, dans la leçon, nous devrons donner une caractéristique comparative de ces éléments en utilisant des connaissances obtenues précédemment.
Dans ordinateurs portables, les étudiants écrivent le sujet de la leçon: " Caractéristiques comparatives Éléments de carbone et de silicium. "
Comparez, cela signifie choisir tout d'abord la comparaison des critères. Dis-moi, s'il vous plaît, quels critères nous, à votre avis, devraient comparer. Les élèves répondent: Position dans PS, la structure des atomes, la valence, l'oxydation et similaires.
^ 2 cours de scène
En utilisant des connaissances de la structure des atomes, la caractéristique des éléments par position dans le PS, les étudiants eux-mêmes se remplissent tableau comparatif № 1.
Tableau n ° 1. Caractéristiques comparatives des éléments de carbone et de silicium
| ^ Comparaison des critères | DE carbone | SI silicium |
| Position dans ps. | 2 Période, GROUPE IV, Sous-groupe principal (a) | 3 Période, GROUPE IV, Sous-groupe principal (A) |
| Atomes de construction | Z i \u003d + 6, p \u003d 6, e \u003d 6, n \u003d 12-6 \u003d 6, externe e \u003d 4 | Z i \u003d + 14, p \u003d 14, e \u003d 14, n \u003d 28-14 \u003d 14, EXTERNE E \u003d 4 |
| Configuration électronique des atomes | 1S 2 2S 2 2P 2 | 1s 2 2S 2 2P 6 3S 2 3P 2 |
| Valence Opportunités | II dans un état stationnaire IV dans un état excité |
|
| Degrés d'oxydation possibles | de -4 à +4 CH 4, C 2 H 6, C 2N 4, CAC 2, C, C 2 F 2, CO, C 2 F 6, CO 2 | -4, 0, +2, +4 Mg 2 si, si, sio, sio 2 |
| Rayon atome | augmente |
|
| Électricité (sur la valeur authentique) | 2,5 | 1,9 |
| La formule d'oxyde plus élevé, son caractère, nom | CO 2 - Monoxyde de carbone (IV), dioxyde de carbone, dioxyde de carbone | SiO 2 - Acide, oxyde de silicium (IV) |
| Formule d'hydroxyde supérieur, son caractère, nom | H 2 CO 3 - Acide instable faible (CO 2 + H 2 O), Sels - Carbonates | H 2 SiO 3 est un acide faible, a une structure de polymère (SiO 2 NH 2 O), sels - silicates |
| Connexion à l'hydrogène | CH 4 - méthane | Sin 4 - Silan (instable) |
| Dans la nature | Élément requis des substances organiques | L'élément le plus courant (après oxygène) de la croûte terrestre |
À la fin du travail indépendant sur le remplissage de la table, tout avec l'enseignant remplit d'avance écrit sur la table du tableau. Dans le processus de remplissage conjoint, les étudiants avec l'enseignant célèbrent, ils prononcent certaines caractéristiques des éléments auxquels il est nécessaire de faire attention à:
Presque dans tous ses composés, le carbone et le silicium sont tétravalent, c'est-à-dire Les atomes de données d'éléments sont dans l'état excité. L'enseignant (étudiant) le montre au tableau:
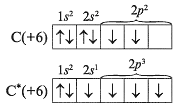
Une variété de degrés d'oxydation dans des atomes de carbone due à l'existence composés organiques, dans les substances inorganiques de ses degrés d'oxydation les plus caractéristiques: -4, 0, +2, +4
La différence caractéristique du carbone et du silicium est la capacité de carbone à la formation de la chaîne. Les atomes de carbone, se connectant les uns avec les autres, forment des composés stables, des composés de silicium similaires sont instables.
^ 3 cours de scène
Des caractéristiques des éléments chimiques - à des substances simples.
Travailler avec une présentation informatique.
Pour les atomes de carbone, une allotropie est caractérisée. Les élèves rappellent la définition du concept - "Allhotropy". L'enseignant demande: "Quels éléments chimiques précédemment couverts ont des modifications allotropes?".
EXEMPLES D'ÉTUDIANTS D'EXEMPLES: Élément d'oxygène (O) - O 2 - Oxygène, O 3 - Ozone; Élément SERA (S) - Crystal et soufre en plastique.
En outre, l'enseignant demande aux étudiants, les modifications de carbone Alto peuvent être connues pour eux.
Le carbone existe sous la forme des substances simples suivantes: diamant, graphite, carbines, fullerène. Charbon, la suie peut être considérée comme des variétés de graphite.
D'intérêt est le charbon de bois.
Avec lui, une autre personne primitive était familière: il l'a trouvé au milieu du feu et après le feu de joie. Le charbon de bois a une grande porosité et ne coule pas. En 1785, un scientifique - un chimiste de Toviy Lovitz a versé par inadvertance de l'acide de vin (couleur brune due aux impuretés) sur un mélange de sable avec charbon. Lovitz assembla la solution pulvérisée, la filtrait du sable avec du charbon. Une substance incolore reste dans le filtre. Il s'est avéré que le charbon a absorbé des impuretés contenues dans Wickcye. Donc, il y avait un phénomène ouvert, appelé Adsorption.
Adsorption - Propriétés du charbon et autres solides Tenez la gase sur sa surface et ses solutés. Les substances, sur la surface de l'adsorption se produisent, s'appelle des adsorbants.
L'adsorption du charbon est causée par sa porosité. Plus les pores, mieux la capacité de sorption du charbon. Mais, généralement, les pores du charbon sont remplis de diverses substances. Pour les purifier, le charbon est chauffé dans le jet de vapeur d'eau. Un tel charbon, avec des pores pelés, est appelé activé.
D'abord guerre mondialeLe phénomène d'adsorption a été appliqué dans la lutte contre les substances d'empoisonnement combattant. Chlore (gaz suffocant) a été appliqué en 1915 sur front occidental Près de la ville d'IPRA contre les troupes anglais-françaises. Attack chlore de lutter contre la capacité de combat à une division entière (15 000 personnes étaient désactivées, 5 mille sont morts).
Le professeur russe Nikolay Zelinsky (un académicien) a inventé et mené un test en juillet 1915 Gase, agissant sur la base du phénomène d'adsorption.
Le silicium forme une substance simple - silicium cristallin. Il y a aussi de la poudre de silicium amorphe couleur blanche.
Ensuite, l'enseignant arrête et désigne les propriétés physiques de chaque substance simpleformé par des atomes de carbone (diapositives).
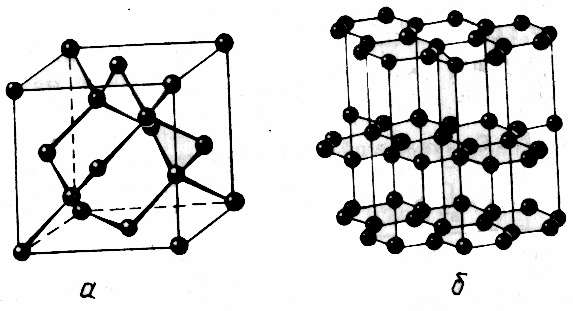
L'enseignant attire l'attention des étudiants au fait que le diamant et le graphite constitué d'atomes de carbone ont des propriétés physiques telles. Pourquoi? (Les étudiants peuvent ne pas toujours répondre à cette question). L'enseignant attire l'attention sur la diversité des différentes structures de lattices de diamant et de cristaux de graphite.
Dans le cristal de diamant, chaque atome de carbone forme quatre liaisons covalentes fortes, elles sont dirigées vers les sommets du tétraèdre, toutes les distances entre les atomes sont les mêmes. Dans le graphite, la distance entre les atomes de la couche est beaucoup plus petite que la distance entre les couches (échantillons de gratinages cristallins).
^ 4 cours de scène
Son objectif: expansion de la structure générale des étudiants, l'établissement d'interprétation de la chimie avec l'histoire.
Dans la leçon précédente, comme devoirs, enseignant a offert aux étudiants de trouver faits intéressants Sur l'histoire de la diamant et préparez une performance avec une présentation informatique.
S'il y a des étudiants qui ont terminé la tâche, l'enseignant leur fournit le mot, sinon, il dit et montre sa présentation.
^ 5 cours de scène
Résumant. Réflexion.
Les étudiants répondent aux questions:
Quels nouveaux concepts ont été étudiés dans la leçon?
Quelles questions ont causé des difficultés? Etc.
L'enseignant met l'évaluation de ces étudiants qui ont montré une bonne et une excellente connaissance au cours de la leçon étaient actifs.
Bibliographie:
Levkin.n. Chimie générale et inorganique: matériaux pour examens. - SPB.: "Parité", 2003 - 240 s.
Malinovskaya Yu.v.v. Chimie. Cours de 6e année / propadeautique. - SPB.: Icar aussi, 2002, - 76 p.
Taube P. R., Rudenko E. I. De l'hydrogène à Nobelia? - M.: Gosdo. Édition lycée", 1961 - 330 p.
Chimie: un manuel pour 9 cellules. UCH. / Rudzitis G.e., Feldman F.G. - 11ème éd. Père. - M.: Enlightenment, 2010
Le numéro de séquence est de 14, la charge du noyau +14, des protons dans le noyau - 14, des électrons - 14. La période des électrons III-14 se déplace le long de trois niveaux d'énergie. Le nombre du groupe IV - au niveau de l'énergie externe est de 4 électrons. Le rayon de l'atome est plus qu'en carbone - la capacité de retourner les électrons augmente. Les propriétés de métaux et de réhabilitation augmentent (en comparaison avec le carbone). Si ge ge sn pb. caractéristiques générales Silicium sur la position dans le système périodique. C.
Photo 2 de la présentation "Silicon" Aux leçons de chimie sur le sujet "Silicon"Dimensions: 960 x 720 pixels, format: jpg. Pour télécharger une image pour la leçon de chimie, cliquez sur l'image du bouton droit de la souris et cliquez sur "Enregistrer l'image comme ...". Pour afficher des images dans la salle de classe, vous pouvez également télécharger la présentation de "Silicon .ppt" entièrement avec toutes les images de la fermeture à glissière. La taille des archives est de 562 kb.
Télécharger la présentationSilicium
"Leçon de silicium" - dioxyde de carbone sur lui-même et l'humanité. Travailler en paires, test mutuel - Aucune erreur (5), deux erreurs - (4), etc. 3% dans l'air - vertiges, bruit dans les oreilles, somnolence. 20% - tout pour une personne. Sur la manifestation des propriétés non métalliques et métalliques. Estimation de la commande. Que peut-on dire de la taille des atomes de rayon de carbone à mener?
"Silicon et ses composés" - envisager des composés de silicium naturels. Donnez à l'élément caractéristique global du silicium. Obtenir du silicium. Silicon a été découvert pour la première fois en 1811 par Gay Lyssak et Terra. La structure et les propriétés des atomes. L'oxyde de silicium, contrairement à l'oxyde de carbone (IV), n'interagit pas avec de l'eau. Semi-conducteur. TPLANT (SI) \u003d 1415? C, Taplav (Diamond) \u003d 3730? C.
"Isotopes en silicone" - Obtention de silicium polycristallin. La dépendance de la position du maximum de la bande de diffusion de combinaison de la masse atomique. Brûleur. Faire une seule graine de cristal. Silicon purifié zono. Couvre protecteur. La conductivité thermique du silicium-28 enrichi de l'isotope. Cultiver des seuls cristaux. La distribution de la concentration des isotopes par la longueur de la graine.
"Composés de silicium" - une variété de quartz. Jaspe. Se faire des silicates. Silicates naturelles. Oxyde de silicium. Minéraux basés sur SiO2. Propriétés chimiques SiO2. Ouverture de silicium. Silicon et ses connexions. Silicium. Agate. Le degré d'oxydation. Configuration électronique. Silicates et hydrogène. Strass. Trouver dans la nature. Sylan.
"Carbon et silicium" - Propriétés chimiques. L'un des solides les plus légers. Briques de silicate. Ce mélange est appelé gaz de générateur. Fig.1 Modèle de réseau de diamants. Le gaz résultant est constitué d'azote libre et d'oxyde de carbone (II). Plus de 99% du carbone dans l'atmosphère est contenue sous forme de dioxyde de carbone. Position dans PSHE.
"Silicon" - jusqu'à ce que la fin de l'apparition de silicium ne soit pas assez de 4 électrons. Oxyde de silicium (IV). La caractéristique globale du silicium sur la position dans le système périodique. Dans les laboratoires de silicium, restauration de l'oxyde de silicium SiO2. Propriétés physiques. Silicatats - sels d'acide silicique. Industrie du silicate.
Total dans le sujet de 6 présentations
Le silicium est un élément essentiel de la croûte terrestre, il se classe après l'oxygène (environ 27,6%).
Silicon a trois isotopes: i (92,27%); (4,68%); (3,05%).
Le silicium existe dans deux modifications allotropiques: amorphe et cristal. La différence de structure détermine la différence entre les propriétés physiques de ces modifications. Silicium amorphe - Poudre brune, n'a pas de point de fusion. Silicium cristallin apparence Il ressemble à un métal, gris foncé avec paillettes métalliques, réfractaire (point de fusion de 1400 ° C), mais il n'est pas attribué aux métaux, car il est fragile, il conduit légèrement le courant électrique et se manifeste propriétés chimiques non-métaux.
Structure silicium cristallin Semblable à la structure du diamant. Dans son cristal, chaque atome est connecté à quatre autres liaisons covalentes. De plus, la liaison covalente entre les atomes de silicium est beaucoup plus faible qu'entre les atomes de carbone en diamant. Même dans des conditions normales, certaines connexions sont détruites et des électrons libres apparaissent, qui provoquent une petite conductivité électrique. Lorsqu'il est chauffé et illumination, le nombre de liaisons destructeurs augmente, par conséquent, plus d'électrons libres apparaissent, la conductivité électrique augmente.
Silicon cristal - semi-conducteur. Les semi-conducteurs appellent des substances dont la conductivité électrique occupe un lieu intermédiaire entre la conductivité des métaux et des diélectriques. De plus en détail, vous étudierez ce phénomène dans les leçons de la physique au lycée. Sur cette propriété, l'utilisation de silicium est basée sur la fabrication de redresseurs AC et de panneaux solaires qui convertissent l'énergie thermique du soleil en électricité. Ces batteries sont installées sur les satellites artificiels de la Terre, sont utilisées dans des conditions terrestres.
La structure diverses de silicium (amorphe et cristalline) détermine la différente activité chimique des modifications allotropes. Dans des conditions normales, le silicium cristallin est inerte et des brûlures amorphes en fluor:

Lorsque le silicium chauffé, il interagit avec de nombreux non-métaux (oxygène, chlore, azote, carbone, gris), et il est mis en évidence un grand nombre de Chaud. Silicon se connecte avec des métaux. Ces composés sont appelés siliciure.
La tâche. Tâche 1. Écrivez les équations de réaction correspondantes et spécifiez les fonctions de silicium dans les réactions d'oxydation.
Tâche 2. Écrivez les équations de réactions de silicium chimique avec magnésium, aluminium. Spécifiez l'oxydant, réduisant l'agent. Sortez le degré d'oxydation expose le silicium.
Les acides (à l'exception du fluide HF) n'agissent pas sur le silicium, cependant, lors du tissage des hydroxydes métalliques en métal alcalin avec du silicium, le sel de silicate est formé - silicate et hydrogène:
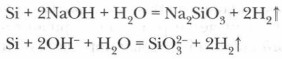
À haute température, le silicium restaure de nombreux métaux de leurs oxydes:
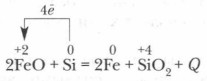
Dans sa forme pure, le silicium ne se trouve pas dans la nature.
Pour la première fois, le silicium a été obtenu en 1822 par le scientifique suédois I. Berzelius en restaurant le fluorure de silicium Sif 4 potassium en métal lorsqu'il est chauffé à 400 ° C. Il est encore plus facile de la rétablir le magnésium métallique SiO 2:
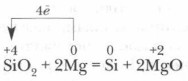
Dans l'industrie du silicium, il est généralement obtenu lorsque le mélange de sable et de coke est chauffé:
Le silicium récupéré réagit partiellement avec un excès de carbone et des formes carborundum Carborund a un réseau cristallin en forme de diamant, des liaisons covalentes de celui-ci sont très durables, donc sur la dureté, il est proche du diamant, est utilisé pour la fabrication de pierres de meulage et de meulage.
La tâche. Comment appeler correctement SIC - Carbure de silicium ou sylocide de carbone? Donner une réponse raisonnable.
Combinaison de silicium
Dans la nature, le silicium est principalement sous la forme de silice (sable) SiO 2 et silicates. Nettoyer les cristaux d'oxyde de silicium (IV) forment plusieurs modifications polymorphes, dont une quartz trouvée sous la forme d'un cristal minier. Cristaux de quartz magnifiquement colorés (améthyste, topaze fumée, morion noire, cornaline, agate, opale, jasper, etc.) sont des pierres semi-précieuses.
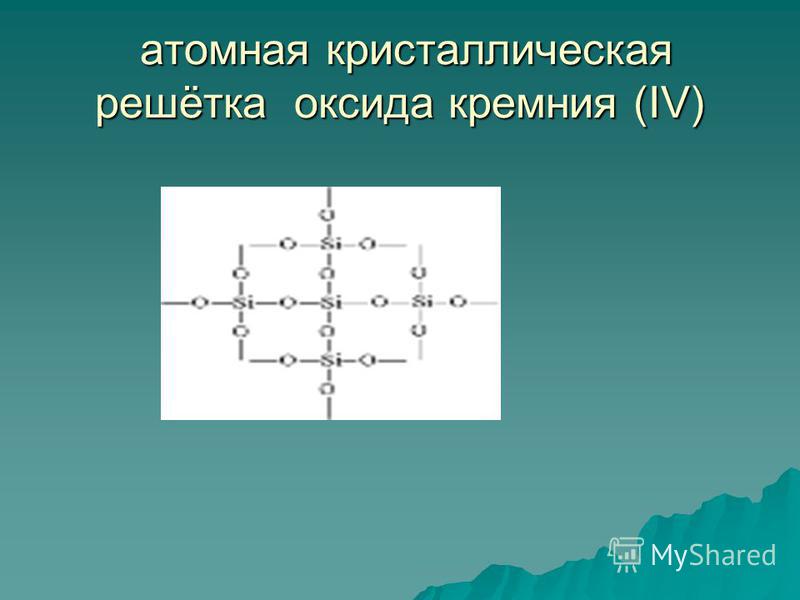
Oxyde de silicium (IV) SiO 2 est une substance réfractaire solide (point de fusion 1713 ° C), insoluble dans de l'eau (Fig. 54). Il possède atomique Le réseau cristallin (Fig. 55): il n'y a pas de molécules, près de chaque atome de silicium, il y a quatre atomes d'oxygène - un particulier cadre spatial. Une pièce de quartz est comme une molécule géante. Quartz est un polymère inorganique, sa formule (SiO 2) n.
Ici, vous pouvez télécharger une leçon sur le sujet: "Position de carbone et de silicium dans un système périodique d'éléments chimiques, la structure de leurs atomes. Charbon, modifications allotropes" pour le sujet: chimie. Ce document vous aidera à préparer un bon et de haute qualité matériau pour la leçon.
Date _____________ Classe _______________
Matière:La position de carbone et de silicium dans le système périodique d'éléments chimiques, la structure de leurs atomes. Carbon, modifications allotropes.
| Le schéma de la construction de l'atome | Structure électronique du dernier niveau d'énergie | La formule de l'oxyde plus élevéRo. 2 | Formule de volatile composé d'hydrogène Rh. 4 | |
| 1. | C.+6) 2 ) 4 | …2 s. 2 2 p. 2 | C. +4 O. 2 | C. -4 H. 4 |
| 2. Silicon | SI +14) 2 ) 8 ) 4 | …3 s. 2 3 p. 2 | SI +4 O. 2 | SI -4 H. 4 |
Comme on peut le voir dans les régimes des atomes, au niveau de l'énergie externe de ces éléments, il y a 4 électrons, par conséquent, du carbone et du silicium montrent le degré d'oxydation +4 et -4.
Depuis le schéma, on peut voir que le volume de carbone a deux électrons non appariés au niveau extérieur (semblable au silicium). Ceci explique que le carbone et le silicium peuvent avoir un degré d'oxydation +2 (par exemple, monoxyde de co-carbone). Se tourner vers un état excité, l'un des S-électrons peut aller à un P-ofRbital gratuit. Ensuite, il semble que 4 électrons non appariés et le degré d'oxydation est de +4 et - 4.
2. Modification des propriétés dans un sous-groupe
Dans un sous-groupe de carbone avec une augmentation du nombre ordinal, la charge du noyau atomique augmente, le nombre d'électrons au niveau externe est constamment, le nombre d'énergie dans les atomes augmente et le rayon de l'atome augmente du carbone à la Le plomb, l'attrait des électrons négatifs au noyau positif est l'affaiblissement et la capacité de retourner des électrons augmente et, par conséquent, dans un sous-groupe de carbone avec une augmentation du nombre de séquences, la diminution des propriétés non métalliques et le métal est amélioré.
C et SI - Non-métaux, Ge - Semiconductor, SN et PB - Métaux.
CARBONE. Carbone altyle
Le carbone est trouvé dans la nature , à la fois sous forme libre et dans les connexions. L'inondation est trouvée sous la forme modifications allotropes - Diamant, graphite, carbin, fullerène.
diamant
La substance cristalline, transparente, réfractée fortement les rayons de la lumière, est très difficile, ne conduit pas de courant électrique, il ne chauffe pas la chaleur, ρ \u003d 3,5 g / cm 3; T ° pl. \u003d 3730 ° C; T ° kip. \u003d 4830 ° C.
Peut être obtenu à partir de graphite à P\u003e 50 mille atm; T ° \u003d 1200 ° C.
Application:
Meulage en poudre, borades, coupe-verre, après coupure - diamants.
Graphite
Substance cristalline, stratifiée, opaque, gris foncé, a une paillettes métalliques, douce, conduit un courant électrique; ρ \u003d 2,5 g / cm 3.
Application:
Les électrodes, les crayons, le ralentisseur de neutrons dans les réacteurs nucléaires font partie de certains lubrifiants.
Karbin
Poudre noire; ρ \u003d 2 g / cm 3; semi-conducteur.
Consiste en des chaînes linéaires -c-c≡c- et \u003d c \u003d c \u003d c \u003d c \u003d.
Quand chauffé passe au graphite.
Leçon

